Papovavirus Uitleg: Oorsprong, Impact en de Voortdurende Strijd Tegen Virale Infecties. Ontdek Hoe Deze Virusfamilie de Moderne Geneeskunde Vormen.
- Introductie tot Papovavirus: Geschiedenis en Classificatie
- Structuur en Genetische Opbouw van Papovavirus
- Transmissiepaden en Gastheerbereik
- Ziekten Geassocieerd met Papovavirus
- Diagnostische Methodes en Detectie
- Huidige Behandelingen en Preventiestrategieën
- Papovavirus in Onderzoek: Vooruitgangen en Toekomstige Richtingen
- Bronnen & Referenties
Introductie tot Papovavirus: Geschiedenis en Classificatie
De term “Papovavirus” verwijst historisch naar een groep kleine, niet-omhulde DNA-virussen die aanvankelijk samen werden gegroepeerd op basis van gedeelde structurele en genetische kenmerken. De naam “Papovavirus” is een acroniem dat is afgeleid van drie prototype-virussen: PApilloma, POlyoma en VAcuolating virus (simian virus 40, SV40). Deze virussen werden voor het eerst geïdentificeerd in het midden van de 20e eeuw tijdens studies naar dierlijke tumoren en virale oncogenese, wat leidde tot aanzienlijke vooruitgangen in het begrip van virale kanker en moleculaire biologie. Vroeg onderzoek toonde aan dat leden van deze groep tumoren konden induceren bij dieren, wat de interesse wekte in hun potentiële rol in menselijke kankers en hun nut als modelsystemen voor het bestuderen van celtransformatie en genregulatie National Center for Biotechnology Information.
In 1999 leidden vorderingen in de moleculaire virologie en fylogenetische analyse tot de herclassificatie van de Papovaviridae-familie in twee afzonderlijke families: Polyomaviridae en Papillomaviridae, zoals erkend door het International Committee on Taxonomy of Viruses (ICTV). Deze reorganisatie was gebaseerd op verschillen in genoomorganisatie, replicatiestrategieën en gastheerbereik. Polyomavirussen en papillomavirussen worden nu als afzonderlijke entiteiten bestudeerd, elk met unieke klinische en biologische betekenis. Ondanks het verouderde karakter van de term “Papovavirus” in de huidige taxonomie, blijft de historische context belangrijk voor het begrijpen van de evolutie van de virologie en de classificatie van DNA-tumorvirussen.
Structuur en Genetische Opbouw van Papovavirus
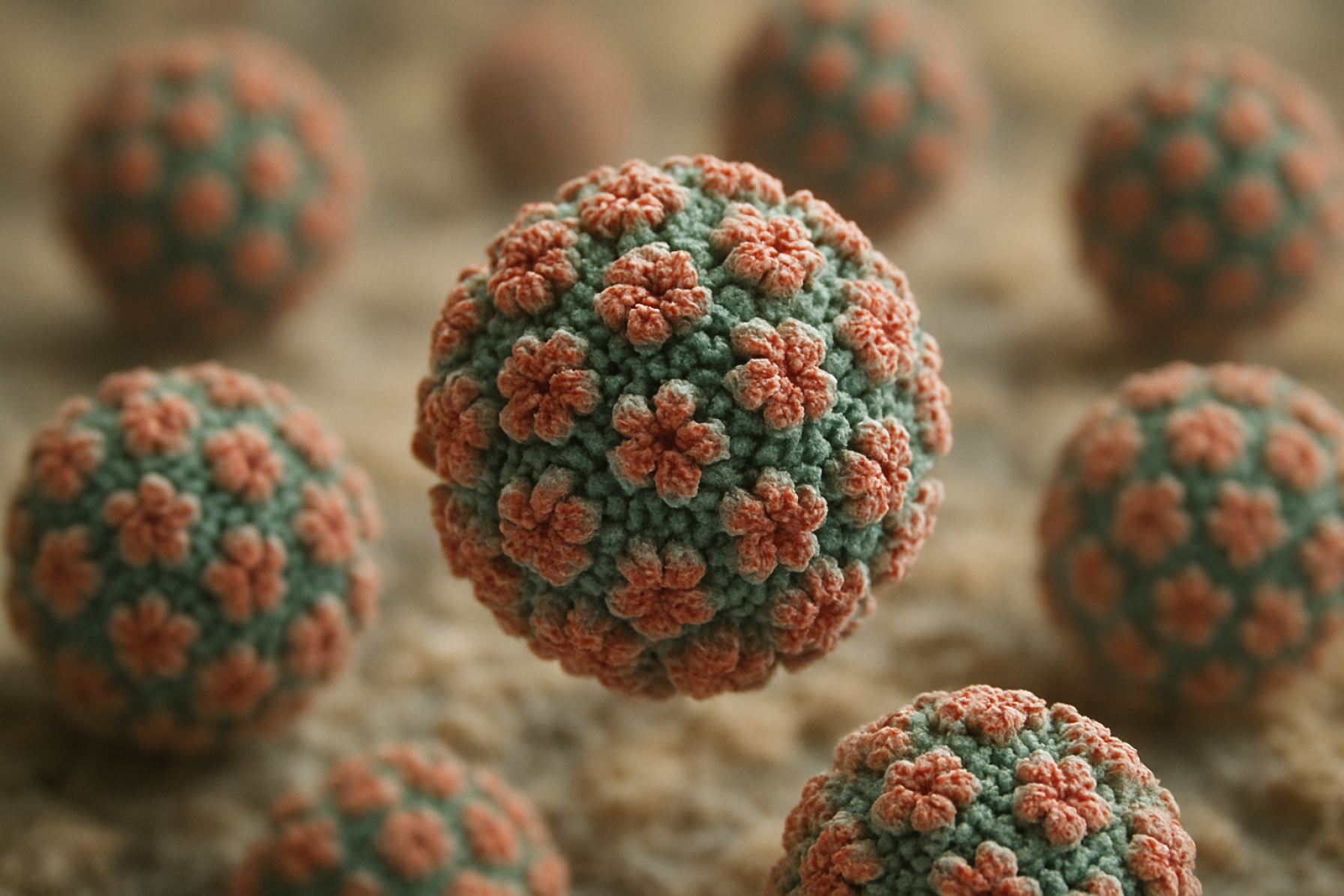
Papovavirussen zijn niet-omhulde, icosahedrale virussen met een diameter van ongeveer 40–55 nm. Hun capside is samengesteld uit 72 capsoomeren, wat zorgt voor structurele stabiliteit en weerstand tegen omgevingsfactoren. Het virale genoom bestaat uit een circulaire, dubbelstrengs DNA-molecuul, dat typisch varieert van 5.000 tot 8.000 basenparen in lengte. Dit genoom is stevig geassocieerd met cellulaire histonen, waardoor een minichromosoomachtige structuur binnen de virion ontstaat, wat ongebruikelijk is voor DNA-virussen en bijdraagt aan de regulatie van virale genexpressie.
De genetische organisatie van papovavirussen is relatief compact, met overlappende leesramen en multifunctionele regulerende gebieden. Het genoom is verdeeld in vroege en late regio’s. De vroege regio codeert voor eiwitten die betrokken zijn bij de virale replicatie en de regulatie van de gastheercelcyclus, zoals het grote T-antigeen in polyomavirussen en de E6/E7-eiwitten in papillomavirussen. De late regio codeert voor structurele eiwitten, voornamelijk de belangrijkste en bijkomende capside-eiwitten (bijv. VP1, VP2 en VP3 in polyomavirussen; L1 en L2 in papillomavirussen), die essentieel zijn voor de virionassemblage en infectiviteit.
Papovavirussen repliceren in de kern van de gastheercel, waarbij ze gebruikmaken van de gastheer-DNA-polymerasen voor genoomreplicatie. Hun unieke genetische en structurele kenmerken zijn uitgebreid bestudeerd, wat inzichten heeft verschaft in virale oncogenese en de ontwikkeling van virusgebaseerde vectoren voor gentherapie. Voor verdere details over de structuur en genetica van papovavirussen, verwijs naar bronnen van de Centers for Disease Control and Prevention en het National Center for Biotechnology Information.
Transmissiepaden en Gastheerbereik
Papovavirussen, historisch omvatting de families Papillomaviridae en Polyomaviridae, vertonen diverse transmissiepaden en een breed gastheerbereik. Transmissie vindt meestal plaats via direct contact met geïnfecteerd weefsel, lichaamsvloeistoffen of verontreinigde oppervlakken. Bijvoorbeeld, humane papillomavirussen (HPV’s) worden voornamelijk verspreid via huid-op-huid of seksueel contact, terwijl polyomavirussen zoals BK- en JC-virussen vaak worden overgedragen via ademhalingsdruppels, urine of verontreinigde waterbronnen. Verticale transmissie van moeder op kind is ook gedocumenteerd in bepaalde gevallen, vooral met enkele polyomavirussen Centers for Disease Control and Prevention.
Het gastheerbereik van papovavirussen is uitgebreid en infecteert een verscheidenheid aan gewervelde diersoorten. HPV’s zijn zeer soort-specifiek en infecteren voornamelijk mensen, terwijl polyomavirussen een breder scala aan zoogdieren en vogels kunnen infecteren. De specificiteit van gastheerinfectie wordt grotendeels bepaald door de interactie tussen virale capside-eiwitten en de oppervlakte-receptoren van de gastheercel, wat invloed heeft op weefsel tropisme en ziekteverschijnselen. Opmerkelijk is dat sommige dierlijke polyomavirussen, zoals het simian virus 40 (SV40), zijn bestudeerd vanwege hun vermogen om soortenbarrières te overschrijden onder experimentele omstandigheden, wat zorgen oproept over het zoonotische potentieel National Center for Biotechnology Information.
De environmentele stabiliteit van papovavirussen vergemakkelijkt verder hun transmissie, aangezien deze niet-omhulde virussen lange tijd op oppervlakken kunnen bestaan. Deze veerkracht benadrukt het belang van hygiëne en desinfectie om verspreiding te voorkomen, vooral in zorginstellingen en gemeenschappelijke omgevingen. Het begrijpen van de transmissiedynamiek en gastheerspecificiteit van papovavirussen is cruciaal voor het ontwikkelen van effectieve openbare gezondheidsinterventies en het beheersen van gerelateerde ziekten.
Ziekten Geassocieerd met Papovavirus
Papovavirussen, historisch geclassificeerd als een familie van kleine, niet-omhulde DNA-virussen, zijn nu verdeeld in twee hoofdfamilies: Papillomaviridae en Polyomaviridae. Deze virussen zijn geassocieerd met een reeks ziekten bij mensen en dieren, waarbij ze voornamelijk epitheliale en neurale weefsels aantasten. De meest klinisch significante ziekten die aan papovavirussen zijn gekoppeld, worden veroorzaakt door humane papillomavirussen (HPV’s) en humane polyomavirussen.
HPV’s zijn goed bekend om hun rol bij de ontwikkeling van goedaardige en kwaadaardige laesies. Laag-risico HPV-types zijn verantwoordelijk voor gewone wratten en genitale wratten, terwijl hoog-risico types, zoals HPV-16 en HPV-18, etiologisch zijn gekoppeld aan baarmoederhalskanker, evenals andere anogenitale en orofaryngeale kankers. Het oncogene potentieel van deze virussen wordt toegeschreven aan hun vermogen om in het gastheergenoom te integreren en de regulatie van de celcyclus te verstoren, wat leidt tot kwaadaardige transformatie Centers for Disease Control and Prevention.
Polyomavirussen, waaronder BK-virus en JC-virus, zijn doorgaans asymptomatisch bij immunocompetente individuen, maar kunnen ernstige ziekten veroorzaken bij immunocompromitteerde gastheren. BK-virus is geassocieerd met nefropathie en hemorragische cystitis, vooral bij niertransplantatie-ontvangers, terwijl JC-virus de veroorzaker is van progressieve multifocale leukoencefalopathie (PML), een demyeliniserende ziekte van het centrale zenuwstelsel die wordt waargenomen bij patiënten met geavanceerde immunosuppressie Centers for Disease Control and Prevention.
Samenvattend zijn papovavirussen gekoppeld aan een spectrum van ziekten, variërend van goedaardige proliferatieve laesies tot levensbedreigende kwaadaardigheden en neurologische aandoeningen, wat hun aanzienlijke impact op de volksgezondheid benadrukt.
Diagnostische Methodes en Detectie
Diagnostische methoden voor het detecteren van papovavirussen, die de families Polyomaviridae en Papillomaviridae omvatten, zijn aanzienlijk geëvolueerd met vooruitgangen in de moleculaire biologie. Traditionele detectie was afhankelijk van histopathologisch onderzoek, waarbij kenmerkende cytopathische effecten zoals koilocytose in epitheloïde cellen wezen op papillomavirusinfectie. Deze methoden missen echter specificiteit en gevoeligheid, vooral bij latente of subklinische infecties.
Tegenwoordig zijn moleculaire technieken de gouden standaard voor de detectie van papovavirussen. Polymerase-kettingreactie (PCR)-testen worden veel gebruikt vanwege hun hoge gevoeligheid en specificiteit. PCR kan viraal DNA detecteren in weefselbiopten, swabs of lichaamsvloeistoffen, en kan worden aangepast om specifieke virale genotypes te identificeren, wat cruciaal is voor epidemiologische studies en voor het onderscheiden van hoog-risico en laag-risico humane papillomavirus (HPV)-types. Real-time kwantitatieve PCR (qPCR) maakt bovendien kwantificering van de virale lading mogelijk, wat belangrijk kan zijn voor het volgen van ziekteprogressie of respons op therapie Centers for Disease Control and Prevention.
Naast PCR maken in situ hybridisatietechnieken (ISH) het mogelijk om virale nucleïnezuren binnen weefselsecties te lokaliseren, wat zowel diagnostische als onderzoekswaarde biedt. Serologische assays, zoals enzymgekoppelde immunosorbentassays (ELISA), worden gebruikt om antilichamen tegen virale eiwitten te detecteren, wat wijst op een eerdere of aanhoudende infectie, hoewel ze minder nuttig zijn voor acute diagnose vanwege de vertraagde antilichaamrespons World Health Organization.
Opkomende technologieën, waaronder next-generation sequencing (NGS), bieden uitgebreide detectie en genotypering van papovavirussen, wat de ontdekking van nieuwe stammen en co-infecties vergemakkelijkt. Deze geavanceerde methoden zijn steeds belangrijker voor surveillance, vaccinontwikkeling en het begrijpen van de pathogenese van papovavirus-geassociëerde ziekten.
Huidige Behandelingen en Preventiestrategieën
Huidige behandelingen en preventiestrategieën voor papovavirusinfecties, die voornamelijk humane papillomavirussen (HPV’s) en polyomavirussen omvatten, richten zich op zowel therapeutische als profylactische benaderingen. Voor HPV, dat is geassocieerd met baarmoederhalskanker en andere anogenitale kankers, evenals orofaryngeale kankers, is de meest effectieve preventieve maatregel vaccinatie. Profylactische vaccins zoals Gardasil 9 en Cervarix richten zich op de meest oncogene HPV-types en hebben een hoge werkzaamheid aangetoond bij het voorkomen van infectie en de daaropvolgende ontwikkeling van precancereuze laesies wanneer ze vóór blootstelling worden toegediend Centers for Disease Control and Prevention. Vaccinatieprogramma’s gericht op adolescenten hebben geleid tot aanzienlijke verminderingen in HPV-prevalentie en gerelateerde ziekten in veel landen.
Voor individuen die al met HPV zijn geïnfecteerd, zijn er momenteel geen antivirale medicijnen die het virus rechtstreeks elimineren. Het beheer richt zich op de behandeling van klinische manifestaties, zoals de verwijdering van wratten door middel van cryotherapie, chirurgische excisie of topische middelen zoals imiquimod en podophyllotoxine World Health Organization. Voor hooggradige baarmoederhalslaesies zijn excisionele procedures zoals de loop electrosurgical excision procedure (LEEP) standaard.
Polyomavirusinfecties, zoals die veroorzaakt door BK- en JC-virussen, zijn vooral problematisch bij immunocompromitteerde individuen. Voor deze infecties zijn er geen specifieke antivirale therapieën goedgekeurd; het beheer is voornamelijk ondersteunend, waarbij het verminderen van immunosuppressie de belangrijkste strategie is bij transplantontvangers UpToDate. Onderzoek naar gerichte antivirale middelen en immunotherapieën is gaande, maar preventie is momenteel afhankelijk van zorgvuldige monitoring en vroege interventie.
Papovavirus in Onderzoek: Vooruitgangen en Toekomstige Richtingen
Papovavirussen, historisch omvatting de Polyomaviridae en Papillomaviridae families, zijn van cruciaal belang geweest in het virologisch onderzoek vanwege hun unieke replicatiemechanismen en oncogene potentieel. Recente vorderingen in de moleculaire biologie en genomica hebben ons begrip van de biologie van papovavirussen aanzienlijk uitgebreid, vooral in de context van virus-gastheer interacties, virale oncogenese en strategieën voor immuunontwijking. High-throughput sequencing en CRISPR-gebaseerde genbewerking hebben onderzoekers in staat gesteld het virale genoom te ontleden en kritieke regulerende elementen te identificeren die betrokken zijn bij celtransformatie en persistentie National Center for Biotechnology Information.
In kankeronderzoek heeft de rol van humane papillomavirussen (HPV’s) in baarmoederhalskanker en andere anogenitale kankers geleid tot de ontwikkeling van profylactische vaccins, die opmerkelijke werkzaamheid hebben aangetoond bij het verminderen van HPV-geassocieerde maligniteiten Centers for Disease Control and Prevention. Evenzo hebben studies naar polyomavirussen, zoals BK- en JC-virussen, inzichten opgeleverd in virale latentheid en reactivatie, met name bij immunocompromitteerde individuen National Cancer Institute.
Kijkend naar de toekomst richt het onderzoek zich op de ontwikkeling van nieuwe antivirale therapieën, verbeterde diagnostische hulpmiddelen en vaccins van de volgende generatie die zich richten op een breder spectrum van papovavirus-types. Bovendien vertegenwoordigen de verkenning van virusachtige deeltjes (VLP’s) als vaccinplatforms en het onderzoek naar virale microRNA’s in de pathogenese veelbelovende toekomstige richtingen. Deze vooruitgangen verbeteren niet alleen ons begrip van papovavirussen, maar dragen ook bij aan bredere toepassingen in kankerpreventie en therapeutische innovatie World Health Organization.
Bronnen & Referenties
- National Center for Biotechnology Information
- Polyomaviridae
- Centers for Disease Control and Prevention
- World Health Organization
- UpToDate
- National Cancer Institute